有關(guān)mRNA疫苗在感染性疾病的研究進(jìn)展

以mRNA為基礎(chǔ)的治療代表了一個(gè)相對(duì)新穎和高效的藥物類別。近發(fā)表的幾項(xiàng)研究強(qiáng)調(diào)了mRNA疫苗在治療不同類型的惡性腫瘤和傳染病方面的潛在療效,這些疾病中傳統(tǒng)的疫苗策略不能引起保護(hù)性免疫反應(yīng)。
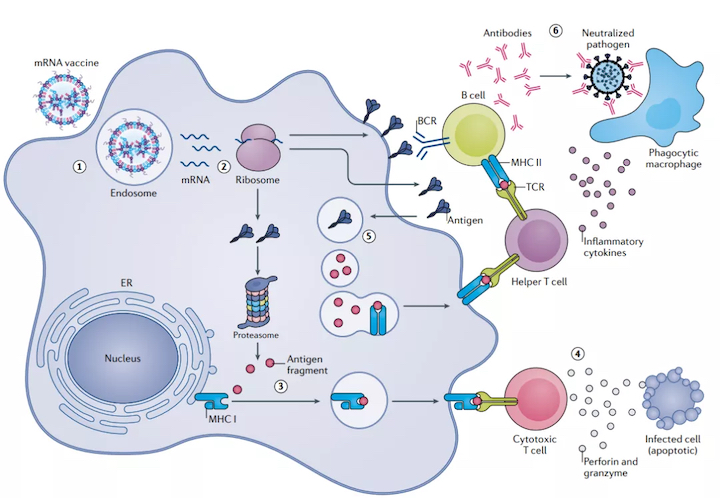
傳染病疫苗是目前mRNA療法中領(lǐng)先的應(yīng)用。目前正在進(jìn)行臨床前試驗(yàn)和臨床使用的大多數(shù)mRNA疫苗都是以單次給藥的形式注射到皮膚、肌肉或皮下,在那里它們被免疫或非免疫細(xì)胞吸收并轉(zhuǎn)化為抗原,展示給T細(xì)胞和B細(xì)胞。
截至2019年底,15種針對(duì)傳染病的候選mRNA疫苗已進(jìn)入臨床試驗(yàn),當(dāng)時(shí),人們認(rèn)為mRNA疫苗至少還需要5-6年才能獲得監(jiān)管部門(mén)的批準(zhǔn)。但是,當(dāng)2020年初COVID-19大流行橫行時(shí),這些期望就被顛覆了。在接下來(lái)的幾個(gè)月里,mRNA疫苗的研發(fā)、制造和部署都進(jìn)入了飛速跨越的階段。
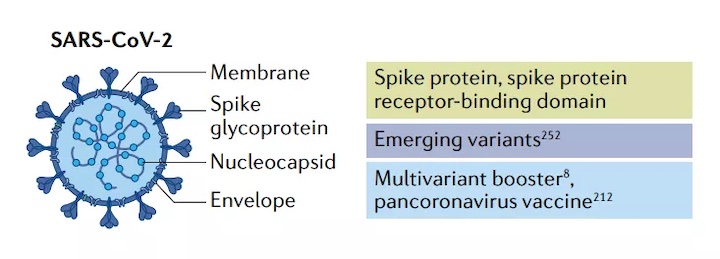
SARS-CoV-2疫苗
大多數(shù)SARS-CoV-2候選疫苗對(duì)病毒表面的棘突蛋白產(chǎn)生免疫反應(yīng)。棘突蛋白與其宿主細(xì)胞表面的受體血管緊張素轉(zhuǎn)換酶2結(jié)合。然后,細(xì)胞的跨膜絲氨酸蛋白酶2將附著的棘突蛋白切開(kāi),該蛋白酶誘導(dǎo)構(gòu)象變化,暴露棘突蛋白的融合肽并促進(jìn)與細(xì)胞或內(nèi)體膜的融合。通常,疫苗mRNA編碼的抗原要么是全長(zhǎng)棘突蛋白,要么是棘突蛋白的受體結(jié)合域。
截至2021年6月18日,185個(gè)CVID-19疫苗候選處于臨床前開(kāi)發(fā)階段,另外102個(gè)已進(jìn)入臨床試驗(yàn)。在臨床試驗(yàn)中,19種為mRNA疫苗。2020年12月11日,輝瑞的BNT162b2疫苗獲得了FDA的緊急授權(quán),成為個(gè)獲準(zhǔn)用于人體的mRNA藥物。一周后,Moderna疫苗mRNA-1273也被授權(quán)在美國(guó)使用。終,它們是批在美國(guó)、英國(guó)、加拿大和其他幾個(gè)獲得授權(quán)的SARS-CoV-2疫苗。
輝瑞和BioNTech共同開(kāi)發(fā)了五種mRNA候選疫苗,它們編碼棘突蛋白抗原的變體。兩個(gè)主要候選藥物BNT162b1和BNT162b2使用Acuitas Therapeutics的可電離脂質(zhì)ALC-0315和核苷修飾的mRNA,其中所有尿苷被N1甲基假尿苷取代,以增強(qiáng)mRNA翻譯。BNT162b1編碼三聚體分泌型棘突蛋白的受體結(jié)合域,而B(niǎo)NT162b2編碼全長(zhǎng)SARS-CoV-2棘突糖蛋白,S2亞基中有兩個(gè)脯氨酸替換,將蛋白鎖定在融合前構(gòu)象。
在兩種疫苗的階段試驗(yàn)中,都可誘導(dǎo)高滴度的中和抗體,并產(chǎn)生強(qiáng)烈的CD4+和CD8+反應(yīng),伴有輕度至中度不良反應(yīng)。兩種候選疫苗耐受性良好且有效,但只有BNT162b2疫苗因其較輕的全身和局部不良反應(yīng)而進(jìn)入II/III期試驗(yàn)。在第三階段試驗(yàn)中,BNT162B2顯示了95%的整體預(yù)防和90~100%的療效。
Moderna與國(guó)立衛(wèi)生研究院合作開(kāi)發(fā)了mRNA-1273。該疫苗使用了可電離脂質(zhì)SM-102制備LNP,該LNP封裝N1甲基假尿苷修飾的mRNA。該序列編碼SARS-CoV-2棘突蛋白,帶有兩個(gè)脯氨酸替換,賦予融合前構(gòu)象。
在1期臨床試驗(yàn)中, mRNA-1273非常有效且耐受性良好。在涉及30420名志愿者的III期試驗(yàn)中,兩支100μg劑量疫苗的預(yù)防率為94.1%,注射部位的局部疼痛是常見(jiàn)的副作用。第二次給藥后,一半的志愿者報(bào)告了中度至重度系統(tǒng)性副作用(例如疲勞、肌肉疼痛、關(guān)節(jié)疼痛),這些副作用在48小時(shí)內(nèi)消失。
盡管輝瑞和Moderna公司生產(chǎn)的疫苗已證明具有良好的療效和安全性,但它們對(duì)冷鏈儲(chǔ)存的需求帶來(lái)了保障的巨大困難。mRNA-1273可在4-8℃下儲(chǔ)存持續(xù)一個(gè)月,而B(niǎo)NT162b2則需要在-60℃條件下儲(chǔ)存。
CureVac的候選疫苗CVnCoV在5℃下可穩(wěn)定儲(chǔ)存3個(gè)月。CVnCoV使用Acuitas Therapeutics(可能是ALC-0315)的可電離脂質(zhì)和編碼具有兩個(gè)脯氨酸替代物的全長(zhǎng)棘突蛋白的未修飾mRNA。在階段臨床試驗(yàn)中,志愿者產(chǎn)生的中和抗體與CVID-19恢復(fù)期患者相似,耐受性良好。然而不幸的是,在包括4萬(wàn)人的III期臨床試驗(yàn)中,CVnCoV僅顯示出47%的療效。中期分析表明,CVnCoV的較低療效歸因于新出現(xiàn)的SARS-CoV-2變異。
目前,CureVac正與GSK合作,開(kāi)發(fā)第二代候選藥物——CV2CoV,該藥物經(jīng)過(guò)優(yōu)化,以增強(qiáng)相對(duì)于CVnCoV的翻譯和免疫原性。CV2CoV使用來(lái)自人類羥基類固醇17-β-脫氫酶4基因的5′UTR和來(lái)自人類蛋白酶體20S亞單位β3基因的3′UTR。在臨床前研究中,CV2CoV在體外顯示出比CVnCoV高1.8倍的蛋白表達(dá),并在大鼠中誘導(dǎo)針對(duì)B.1.1.7、B.1.1.298和B.1.351變體的高滴度交叉中和抗體。
另一種耐熱候選疫苗ARCoV由中國(guó)人民解放軍軍事科學(xué)院與Walvax生物技術(shù)公司合作開(kāi)發(fā),可以在25℃穩(wěn)定一周。ARCoV編碼棘突蛋白的受體結(jié)合域。在臨床前研究中,在食蟹猴中可誘導(dǎo)高SARS-CoV-2特異性IgG抗體和強(qiáng)病毒中和滴度。盡管CVnCoV和ARCoV熱穩(wěn)定性背后的原因尚不清楚,但mRNA二級(jí)結(jié)構(gòu)、較小的mRNA大小、GC含量和脂質(zhì)可能是重要因素。
其它一些mRNA候選疫苗也正在研制中。LNP-nCoVsaRNA由倫敦帝國(guó)理工學(xué)院和Acuitas Therapeutics合作開(kāi)發(fā),編碼全長(zhǎng)棘突蛋白。目前,正在使用0.1–1?g劑量遞增方案進(jìn)行I期臨床試驗(yàn)評(píng)估(ISRCTN17072692),其使用了所有候選mRNA疫苗中低的RNA劑量。
另一種自擴(kuò)增mRNA疫苗候選物ARCT-021(也稱為L(zhǎng)UNAR-COV19)由Arcturus公司利用其專有的LUNAR脂質(zhì)載體和自轉(zhuǎn)錄和復(fù)制RNA(STARR)平臺(tái)開(kāi)發(fā)。它編碼全長(zhǎng)融合前棘突蛋白。
流感病毒疫苗
全每年約有29萬(wàn)至65萬(wàn)人死于流感病毒。目前的疫苗以促進(jìn)病毒進(jìn)入的病毒血凝素蛋白為靶標(biāo)。傳統(tǒng)的流感疫苗是生長(zhǎng)在雞蛋中的滅活流感病毒,生產(chǎn)時(shí)間長(zhǎng),純化困難。此外,病毒會(huì)在雞蛋中發(fā)生變異以獲得佳生長(zhǎng),有時(shí)會(huì)使它們?cè)谌祟愔袩o(wú)效。

因此,確實(shí)需要替代的抗原靶點(diǎn)和生產(chǎn)方法。體外轉(zhuǎn)錄的合成mRNAs可以滿足這一需求,并確保在出現(xiàn)全新流感毒株時(shí)快速生產(chǎn)疫苗。例如,2013年,基于LNP(DLinDMA)的自我擴(kuò)增mRNA疫苗在中國(guó)H7N9爆發(fā)后8天內(nèi)迅速研制成功,然而不幸的是,由于當(dāng)時(shí)沒(méi)有用于mRNA制造的GMP設(shè)施,未能進(jìn)行臨床試驗(yàn)。
也有人致力于研制一種不需要每年修改的通用流感疫苗。這種疫苗可以對(duì)幾種流感病毒株和亞型產(chǎn)生免疫力。在2012年首次展示的流感mRNA疫苗,三次皮內(nèi)注射在小鼠中分別誘導(dǎo)針對(duì)H1N1和H5N1毒株的同源和異源免疫。
值得注意的是,不易發(fā)生突變的血凝素保守柄區(qū)近已成為一種新型通用疫苗靶標(biāo)。還有另一項(xiàng)研究使用LNPs來(lái)遞送50ng劑量的mRNA,編碼三種保守的流感蛋白:神經(jīng)氨酸酶、核蛋白和基質(zhì)-2離子通道蛋白以及血凝素柄區(qū)。令人難以置信的是,這種微小的mRNA劑量產(chǎn)生了廣泛的保護(hù)性抗體。
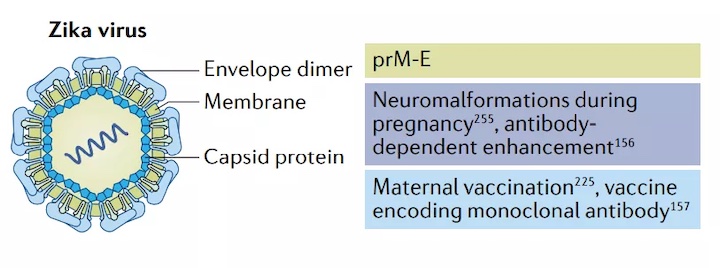
寨卡病毒疫苗
寨卡病毒感染于1947年首次被發(fā)現(xiàn),感染寨卡病毒的患者通常無(wú)癥狀或出現(xiàn)發(fā)熱、皮疹和肌肉疼痛等輕微癥狀。然而,寨卡病毒在2015-2016年美洲流行期間成為全球健康危機(jī),該病毒在懷孕期間導(dǎo)致嚴(yán)重胎兒神經(jīng)畸形和胎兒死亡。膜和包膜蛋白(prM-E)是針對(duì)寨卡病毒的mRNA疫苗常見(jiàn)的抗原選擇,因?yàn)獒槍?duì)prM-E的中和抗體可以防止病毒融合。
Moderna與華盛頓大學(xué)醫(yī)學(xué)院合作,開(kāi)發(fā)了一種改良的prM-E mRNA,其中包含E蛋白中的突變?nèi)诤檄h(huán)形表位。兩個(gè)10?g劑量的mRNA可保護(hù)小鼠免受寨卡病毒攻擊,并減少登革熱增強(qiáng)抗體的產(chǎn)生。這些令人鼓舞的臨床前結(jié)果促進(jìn)了I期試驗(yàn)的進(jìn)行,中期結(jié)果表明,疫苗mRNA-1893在10天內(nèi)誘導(dǎo)94-100%的血清轉(zhuǎn)陽(yáng),耐受性良好。
此外,另一項(xiàng)研究使用被動(dòng)免疫方法,利用基于角鯊烯的納米載體遞送編碼ZIKV中和抗體的mRNA。對(duì)于免疫系統(tǒng)受損而無(wú)法合成自身抗體的免疫缺陷患者來(lái)說(shuō),這是一種很有吸引力的方法。
HIV病毒疫苗
全球范圍內(nèi),艾滋病毒目前影響3800萬(wàn)人,預(yù)計(jì)到2030年將影響多達(dá)4200萬(wàn)人。盡管已進(jìn)行了30年的研究,但尚未開(kāi)發(fā)出有效的疫苗,這主要是因?yàn)镠IV包膜蛋白具有顯著的抗原性多樣性以及隱藏關(guān)鍵包膜蛋白表位“聚糖屏障”。幾項(xiàng)臨床前研究已經(jīng)使用了多種載體,包括陽(yáng)離子納米乳劑、DOTAP/DOPE脂質(zhì)體、Polymers和可電離LNP,它們?cè)诓煌潭瓤吹搅艘恍┬Ч_@些研究表明,除了有效的載體外,新的抗原對(duì)于有效地靶向HIV是非常關(guān)鍵的。

呼吸道合胞病毒疫苗
呼吸道合胞病毒是全球急性下呼吸道感染的主要原因。每年,估計(jì)有60000名5歲以下兒童死亡,超過(guò)14000名65歲以上的人死亡。

目前的RSV候選疫苗主要針對(duì)高度保守的F蛋白。盡管一些候選者由于中和抗體滴度不足而未能通過(guò)臨床試驗(yàn),但對(duì)F蛋白構(gòu)象的新發(fā)現(xiàn)表明,針對(duì)融合前構(gòu)象接種疫苗可產(chǎn)生優(yōu)異的中和抗體反應(yīng)。這一發(fā)現(xiàn)有望改進(jìn)未來(lái)的疫苗設(shè)計(jì)。
Moderna正在評(píng)估編碼融合前F蛋白的三種單劑量候選疫苗:mRNA-1172和mRNA-1777用于成人,以及mRNA-1345用于兒童。在I期臨床試驗(yàn)中,mRNA-1777誘導(dǎo)RSV中和抗體產(chǎn)生強(qiáng)烈的體液反應(yīng),CD4+T細(xì)胞對(duì)RSV F蛋白產(chǎn)生反應(yīng),且無(wú)嚴(yán)重不良事件。mRNA-1345的序列已被進(jìn)一步設(shè)計(jì)和密碼子優(yōu)化,以增強(qiáng)相對(duì)于mRNA-1777的翻譯和免疫原性。接種后1個(gè)月,mRNA-1345產(chǎn)生的中和抗體滴度約為mRNA-1777的八倍。終,Moderna的目標(biāo)是將mRNA-1345與其兒科人類偏肺病毒/副流感病毒3型(hMPV/PIV3)候選疫苗mRNA-1653整合,并用單一配方為兒童接種針對(duì)三種不同病原體的疫苗。
埃博拉病毒疫苗
埃博拉病毒(EBOV)于1976年首次被確定為導(dǎo)致埃博拉病爆發(fā)的病原體。這種病毒性出血熱在2014-2016年西非埃博拉疫情中奪走了11000多條生命。2019年,F(xiàn)DA批準(zhǔn)了一種基于重組水泡性口炎病毒(VSV)的埃博拉疫苗(rVSV-EBOV)。盡管與未接種疫苗相比,rVSV-EBOV在預(yù)防埃博拉傳播方面的有效性為97.5%,但臨床試驗(yàn)注意到一些安全問(wèn)題(例如急性關(guān)節(jié)炎和皮疹)。

抗EBOV的mRNA疫苗可能比這種基于病毒的疫苗更安全,因?yàn)樗鼈儾粫?huì)在體內(nèi)復(fù)制。一種編碼EBOV糖蛋白的mRNA疫苗已在小鼠中證明了效力。該疫苗通過(guò)CD8+和CD4+T細(xì)胞誘導(dǎo)糖蛋白特異性IgG抗體和IFN-γ以及IL-2的強(qiáng)烈表達(dá),可保護(hù)動(dòng)物免受致命病毒的傷害。
狂犬病毒疫苗
狂犬病是一種人畜共患病,以神經(jīng)癥狀為特征,死亡率近100%。盡管已有疫苗獲批,但每年仍有5萬(wàn)多人死于狂犬病,這突出表明需要更有效、更廉價(jià)的疫苗。
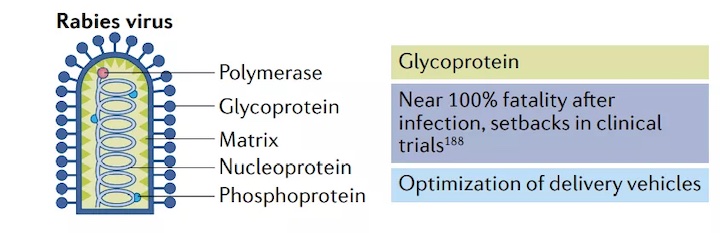
為了滿足這一需求,CureVac利用其RNActive平臺(tái),篩選出編碼狂犬病病毒糖蛋白的未經(jīng)修飾的mRNA疫苗CV7201。在一項(xiàng)臨床前研究中,CV7201可誘導(dǎo)小鼠和豬的高中和抗體滴度,并誘發(fā)抗原特異性CD4+和CD8+T細(xì)胞反應(yīng)。但是在I期臨床試驗(yàn)中發(fā)現(xiàn),雖然給藥途徑不影響免疫反應(yīng),但給藥裝置只有皮內(nèi)注射器產(chǎn)生短暫的體液免疫反應(yīng)。這種弱的給藥效果以及高發(fā)生率的不良事件表明需要進(jìn)一步優(yōu)化給藥平臺(tái)。
隨后,CureVac使用Acuitas Therapeutics生產(chǎn)的專有LNP作為其新疫苗CV7202的載體。在一項(xiàng)臨床前研究中,CV7202誘導(dǎo)產(chǎn)生強(qiáng)抗體滴度和CD8+和CD4+T細(xì)胞反應(yīng)。I期臨床試驗(yàn)結(jié)果表明,兩個(gè)1?g劑量可產(chǎn)生高滴度中和抗體以及強(qiáng)適應(yīng)性免疫反應(yīng),耐受性良好。
瘧原蟲(chóng)疫苗
盡管開(kāi)發(fā)中的絕大多數(shù)mRNA疫苗是為了防止病毒感染,但也有預(yù)防其他傳染病的努力。瘧疾是由單細(xì)胞真核寄生蟲(chóng)引起的,其發(fā)病率和殺傷力位居榜首。每年,瘧疾折磨著全2億多人,奪走40多萬(wàn)患者的生命。由于缺乏表面抗原和瘧原蟲(chóng)的復(fù)雜生命周期,抗瘧疫苗的生產(chǎn)一直很困難。幸運(yùn)的是,人體對(duì)瘧原蟲(chóng)感染的自然免疫反應(yīng)的研究已經(jīng)確定了潛在的非表面抗原靶點(diǎn)。
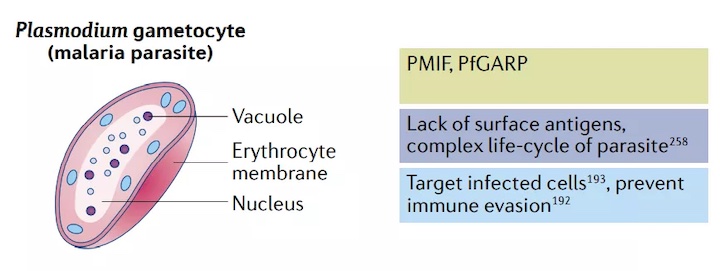
例如,瘧原蟲(chóng)分泌的細(xì)胞因子巨噬細(xì)胞遷移抑制因子(PMIF)已被證明可阻止T細(xì)胞產(chǎn)生長(zhǎng)期記憶。根據(jù)這一發(fā)現(xiàn),從基于角鯊烯的陽(yáng)離子納米乳劑中制備了一種疫苗,該納米乳劑裝載有編碼PMIF的自擴(kuò)增mRNA。兩個(gè)15?g劑量可改善輔助性T細(xì)胞的發(fā)育,并誘發(fā)抗瘧原蟲(chóng)IgG抗體和記憶性T細(xì)胞反應(yīng)。
另一項(xiàng)關(guān)于瘧疾感染的機(jī)制研究發(fā)現(xiàn),惡性瘧原蟲(chóng)富含谷氨酸蛋白(PfGARP)是一種潛在的mRNA疫苗靶點(diǎn)。一種編碼PfGARP抗原的核苷修飾mRNA疫苗正在開(kāi)發(fā)中,該疫苗使用了Acuitas Therapeutics專有的LNP。臨床前研究表明,該疫苗可以降低動(dòng)物感染瘧原蟲(chóng)后的反應(yīng)。
本文轉(zhuǎn)載自:“藥時(shí)空”公眾號(hào),如有侵權(quán)請(qǐng)聯(lián)系刪除
關(guān)于綠綿科技
北京綠綿科技有限公司(簡(jiǎn)稱:綠綿科技)以體現(xiàn)客戶服務(wù)價(jià)值為宗旨,以專業(yè)精神和技能為廣大實(shí)驗(yàn)室分析工作者提供樣品前處理、樣品制備及分析、實(shí)驗(yàn)數(shù)據(jù)精確分析和管理的全面解決方案,致力于協(xié)助客戶提高分析檢測(cè)的效率和水平。主要代理產(chǎn)品聯(lián)系電話:010-82676061/2/3/4/5/6/7/8
E-mail:[email protected]。
